La production de produits sanguins est fortement réglementée du fait des incompatibilités entre groupes sanguins. Comment sont définis et identifiés les groupes sanguins ? Quelles sont les règles de compatibilité lors de la transfusion sanguine ? Nous aborderons ces questions essentielles ainsi que la définition des principaux produits sanguins.
Acte thérapeutique pratiqué couramment, la transfusion sanguine consiste à apporter au patient (receveur) des concentrés de globules rouges (CGR), du plasma frais congelé (PFC) ou des concentrés plaquettaires (CPA) issus de donneurs de sang, soit suite à une perte brutale de sang (hémorragie), soit suite à une pathologie sanguine ou à une cure de chimiothérapie (aplasie médullaire). Sa réglementation, vaste et complexe, s’applique à l’Établissement français du sang (EFS), aux donneurs, à la préparation, aux contrôles et au transport des produits sanguins labiles, à l’acte transfusionnel, aux suivi des receveurs ainsi qu’à l’hémovigilance.
Sommaire
ToggleLe sang : composition et fonctions
Seul tissu liquide de l’organisme, le sang est composé d’éléments figurés en suspension dans le plasma et se décompose ainsi :
- le plasma qui représente 54 % du volume et se compose d’eau, d’O2, de CO2, de nutriments (glucose, acides aminés, vitamines, cholestérol), d’ions (Na, K, Cl, Fe…) et de protéines (facteurs de la coagulation, albumine, hormones, anticorps…) ;
- les éléments figurés que sont les globules rouges (45 %), les leucocytes et plaquettes (1 %).
Son volume est estimé à 70 ml/kg chez un adulte environ.
Les fonctions principales du sang sont multiples :
- fonction de transport : apport d’O2 et de nutriments, transport des déchets cellulaires (CO2, déchets azotés) et transport des hormones vers les organes cibles ;
- fonction de régulation : maintien de la température corporelle, du Ph normal, du volume adéquate des liquides et de l’équilibre des ions dans le système circulatoire ;
- fonction de protection : prévention de l’hémorragie et de l’infection.
Antigène (Ag) et anticorps (Ac)
Un antigène (Ag) est une substance présente à la surface d’un globule rouge (GR), capable de provoquer une réaction immunitaire.
Un anticorps (Ac) ou globuline plasmatique est une substance contenue dans le plasma, qui réagit spécifiquement avec un antigène.
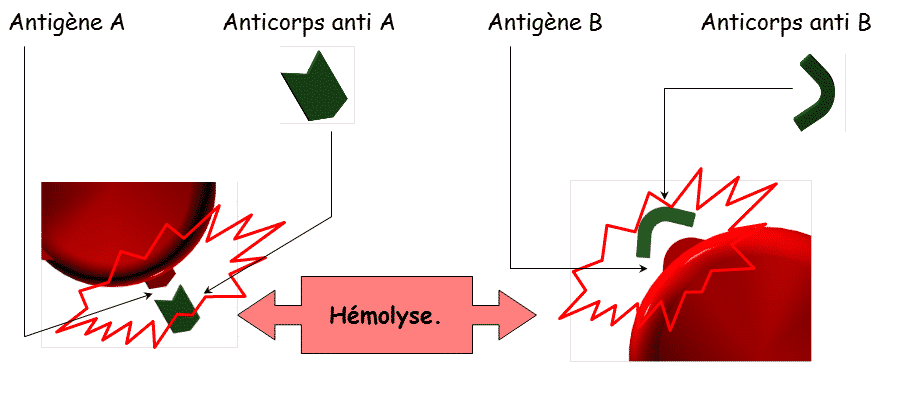
Ainsi, que se passe-t-il si un Ac AntiA rencontre un Ag A (épreuve de Beth Vincent par exemple) ? Dans ce cas, il y a création du couple Ag/Ac (agglutination) ce qui aboutit à une hémolyse des GR (schéma 1).
Transfusion sanguine et les groupes sanguins
Transmis génétiquement, ils sont définis par un ensemble d’antigènes (Ag) présents à la surface du GR et sont révélés par l’agglutination des GR avec des anticorps correspondants. Les antigènes des groupes sanguins sont nombreux (+ de 320) et sont classés en système dont les principaux sont le système A, B, O, AB et le système Rhésus D. Il en existe d’autres : phénotype Rhésus complet C c E e, le système Kell, Duffy, Kidd, Lewis…
Le phénotypage sanguin est la recherche des antigènes à la surface des GR afin de déterminer précisément le groupe sanguin du patient.
RAPPEL
La détermination du phénotype est importante particulièrement pour les patients polytransfusés et les femmes en âge de procréer, afin de ne transfuser que des CGR ayant le même phénotype. Dans le cas contraire, une immunisation contre les antigènes différents apportés par la transfusion pourrait entraîner ultérieurement des accidents transfusionnels ou une maladie hémolytique chez le nouveau-né.
1 Le système ABO
Découvert en 1900, c’est le principal système de groupe sanguin et tissulaire. Il a un rôle important pour la transfusion ainsi que pour les greffes d’organes et de tissus (schéma 2).
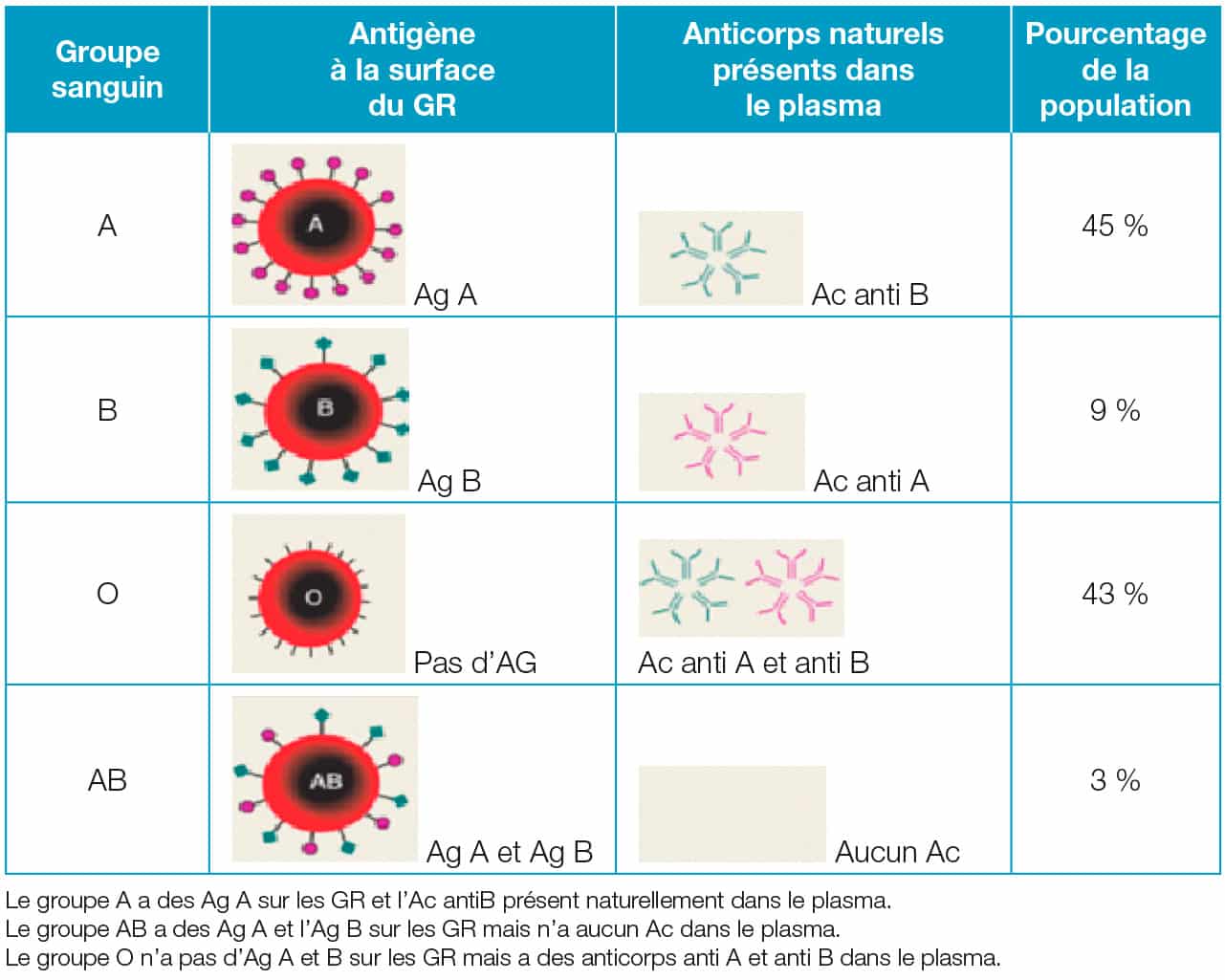
Il comprend deux antigènes A et B présents ou non à la surface des GR. L’appartenance à un groupe sanguin est déterminé par la présence ou l’absence sur les GR de deux antigènes spécifiques : l’Ag A et l’Ag B. De plus, il y a systématiquement présence des Ac antiA et/ou anti b dans le plasma lorsque les GR du patient ne possèdent pas les Ag correspondants (loi de Landsteiner).
La détermination du groupe sanguin s’effectue grâce à deux épreuves : une épreuve globulaire (Beth Vincent) et une épreuve sérique (Simonin). C’est la concordance de ces 2 épreuves qui détermine le groupe ABO du patient.
2. Le système Rhésus, Kell et autres
L’Ag le plus connu du système Rhésus est l’antigène D (RH 1).
Lorsqu’il est présent (D +), ce qui concerne 85 % de la population, cela correspond à Rhésus positif Rh +.
Lorsqu’il est absent (D -), cela correspond à Rhésus négatif Rh -. Ce qui concerne 15 % de la population.
Il existe quatre autres Ag Rhésus importants : Ag C, c, E, e. ils sont recherchés lors du phénotype érythrocytaire.
Lorsqu’un Ag est présent, il est noté « + », lorsqu’il est absent, il est noté « – ».
Il en est de même pour l’Ag Kell et d’autres systèmes tels que Duffy, Kidd, MNS…
Les règles de compatibilité pour la transfusion sanguine de globules rouges
Le principe de la sécurité transfusionnelle est d’éviter la rencontre d’un Ag érythrocytaire (de la poche) avec son Ac naturel spécifique (présent dans le plasma du patient) ce qui provoquerait une hémolyse.
Lors de la transfusion de GR, ce sont les Ag apportés par les GR de la poche qui peuvent rentrer en conflit avec les Ac présents (à l’état naturel) dans le plasma du patient d’où l’intérêt de :
- transfuser des GR dont les principaux Ag sont soit identiques, soit compatibles avec ceux présents sur les GR du patient (ABO Rhésus Kell) ;
- de connaître la présence d’Ac dangereux dans le plasma du patient afi n d’éviter d’apporter, avec la transfusion de GR, le ou les Ag correspondants. La recherche d’agglutinines irrégulières permet de dépister et d’identifier les Ac susceptibles d’entraîner un confl it immunologique.
C’est la raison pour laquelle le groupe O est donneur universel (absence d’Ag présent à la surface des GR) donc il n’y a pas de risque que les Ac du patient s’agglutinent sur les Ag des GR (de la poche).
C’est aussi une des raisons pour laquelle le groupe AB est receveur universel, car il n’a aucun Ac naturellement présents dans son plasma (susceptible de s’agglutiner avec les Ag des GR de la poche) et donc aucun risque d’accident hémolytique.
>> LIRE AUSSI – Décès après une incompatibilité transfusionnelle : Un hôpital devant la justice >>
Compatibilité ABO des globules rouges
Les règles de compatibilité lors de la transfusion des plasmas sanguins
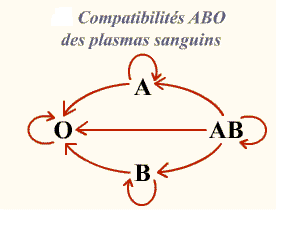
Lors de la transfusion de plasma, le problème immunologique est inversé puisque c’est le produit à transfuser (le plasma) qui risque d’amener des Ac dirigés contre les Ag des GR du patient Ceci concerne essentiellement les Ag du système ABO. L’apport passif d’Ac naturels ABO est le plus souvent sans conséquence pour le patient.
C’est la raison pour laquelle le plasma de groupe AB (aucun Ac anti A ou anti B dans son plasma) est donneur universel et que le patient de groupe O est receveur universel (absence d’Ag sur ces GR) et peut recevoir des plasmas de tous les autres groupes.
Compatibilité ABO des plasmas sanguins
Les produits sanguins
Les produits sanguins sont des préparations obtenues à partir du traitement des dons de sang bénévoles.
On distingue deux catégories de produits sanguins :
- les produits sanguins labiles (PSL) : globules rouges (CGR), plasma frais congelé (PFC), plaquettes (CPA) ;
les médicaments dérivés du sang (MDS) : albumine, facteurs de la coagulation, immunoglobulines.
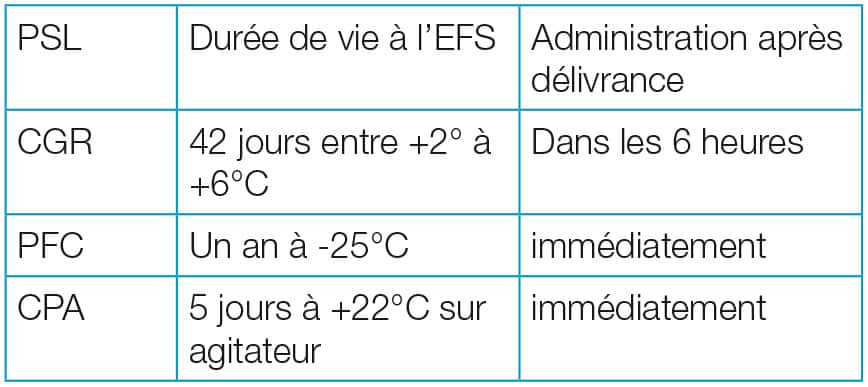
Les PSL sont collectés, préparés et distribués par l’Établissement français du sang (EFS), ont une durée de vie limitée et nécessitent le respect des règles de compatibilité. Malgré de multiples contrôles, il persiste un risque minime de transmission de virus.
Les MDS sont préparés par l’industrie pharmaceutique à partir du plasma humain ou par génie génétique et ont une stabilité beaucoup plus longue. Ils sont dispensés par la pharmacie de l’établissement de soins et nécessitent une traçabilité.
GLOSSAIRE
• Transfusion autologue : les PSL transfusés proviennent de la personne qui est transfusée (en cas de chirurgie programmée, de groupe sanguin rare.
• Transfusion homologue : les PSL transfusés proviennent de donneur de sang.
>> LIRE AUSSI – Salon infirmier 2018 : « Redémarrer l’activité transfusionnelle à domicile » >>
1. Les concentrés de globules rouges
Les CGR contiennent approximativement 250 ml de sang. Il est admis que 1 CGR permet de remonter l’HB du patient de 1g /dl.
Chaque poche est identifiée par un étiquetage mentionnant au minimum :
- un numéro d’identifi cation (11 chiffres) ;
- nature du produit : CGR ;
- le groupe sanguin ABO Rh D ;
- date de prélèvement et de péremption ;
- l’établissement producteur.
Les CGR font systématiquement l’objet d’une déleucocytation.
D’autres informations peuvent apparaître sur les poches :*
- mention Iso groupe ABO : un produit O « isogroupe » ne peut être transfusé qu’à un patient O ;
- CGR phénotypé : C+ c+ E- e+ K – signifie la présence sur les GR des Ag C, c et e et l’absence sur les GR des Ag E et Kell. Les indications des CGR phénotypés concernent les sujets de sexe féminin jusqu’à la ménopause, les sujets polytransfusés, les sujets avec RAI positives afin d’éviter une éventuelle immunisation (apparition d’Ac irréguliers), nuisible à une grossesse ou une transfusion future et afin d’éviter un accident de transfusion par conflit Ag-Ac chez des sujets déjà immunisés ;
- CGR « CMV ou Cytomégalovirus négatif » : la recherche d’anticorps anti CMV est négative au moment du don. Les indications concernent la femme enceinte, la transfusion in utéro, le nouveau-né, le sujet greffé afin d’éviter la transmission du virus à un patient et entraîner une infection grave ;
- CGR déplasmatisé : L’objectif de la déplasmatisation est de réduire au maximum la quantité de protéines plasmatiques dans le CGR. Il est indiqué chez des patients ayant des antécédents de réactions allergiques graves lors de transfusions antérieures dû aux protéines du plasma ;
- CGR irradié : L’irradiation consiste à exposer un CGR à une source de rayonnement ionisant ce qui bloque la fonction des lymphocytes qu’il peut contenir. Il est indiqué en cas de greffe de moelle osseuse, de thérapie cellulaire, de déficits immunitaires congénitaux, de transfusion in utéro ou chez le prématuré. En effet, les lymphocytes transfusés peuvent provoquer chez certains patients immunodéprimés une pathologie appelée « réaction du greffon contre l’hôte ».
Les indications d’une transfusion de CGR sont une anémie aiguë ou chronique mal tolérée cliniquement. Le seuil transfusionnel est fonction du contexte, des antécédents du patient et de la tolérance clinique :
- taux d’Hb inférieur à 7 g/dl chez les personnes sans antécédents particuliers ;
- taux d’Hb inférieur à 10 g/dl chez des personnes ne tolérant pas cliniquement un taux d’Hb inférieur ou atteintes de pathologies coronaires aiguës ou d’insuffisance cardiaque avérée.
>> LIRE AUSSI – Sécurité transfusionnelle : le danger des erreurs de prélèvements >>
2. Le concentré plaquettaire
Ils se présentent sous deux formes :
- concentré de plaquettes standard (CPS) qui correspond à une unité thérapeutique
- concentré de plaquettes d’aphérèse (CPA) qui correspond à 4-12 unités thérapeutiques
L’étiquetage comporte les mêmes mentions que celles des CGR.
Les concentrés de plaquettes se conservent cinq jours, entre +22 et +24°C sur un agitateur (afin d’éviter que les plaquettes s’agglutinent entre elles). Le transport s’effectue à température ambiante.
Elles doivent être administrés immédiatement après leur réception dans le service.
L’indication principale est de prévenir ou de stopper une hémorragie chez des sujets thrombopéniques (plaquettes inférieures à 25 000/mm3).
De la même manière que les CGR, il existe des CPA phénotypés, déplasmatisés, CMV négatif, irradiés…
Lors de la transfusion de plaquettes, les Ag apportés par les produits transfusés et susceptibles d’entrer en conflit avec les Ac présents dans le plasma du patient transfusé sont le plus souvent les Ag du système ABO et du système HLA. L’idéal est donc de transfuser des CPA isogroupe ABO.
>> LIRE AUSSI – Les substituts sanguins à la croisée des chemins >>
3. Le plasma frais congelé
Ils se présentent sous 2 formes :
- le plasma viro-atténué (PVA) : c’est un plasma composé de plusieurs donneurs bénéficiant d’un traitement chimique qui détruit les virus encapsulés puis réparti en poches de 200 ml et congelé.
- le plasma frais congelé d’aphérèse (PFC sécurisé) : plasma validé après contrôle à distance (sup à 3 mois) des sérologies virales du donneur. Le volume varie entre 200 et 600 ml.
Ces poches se conservent maximum un an au congélateur à – 25°C à l’EFS ou au dépôt de sang.
Le transport s’effectue après décongélation, à température ambiante et il doit être administré le plus rapidement possible afin de conserver les propriétés d’hémostase (max 6 heures).
Les indications sont une hémorragie aiguë avec déficit des facteurs de coagulation, une coagulopathie intravasculaire disséminée (CIVD), des déficits rares en facteurs de coagulation.
Laurence Piquard,
Infirmière anesthésiste
Cet article est paru dans le numéro 26 ActuSoins magazine
(Sept/Oct/Nov 2017).
Pour s’ abonner au magazine, c’est ICI
Abonnez-vous au magazine Actusoins
QUELQUES DATES
• 1665 : les premières transfusions sanguines sont réalisées avec du sang animal entrainant de nombreux accidents transfusionnels.
• 1788 : le rôle du sang dans le transport de l’oxygène est découvert.
• 1900 : Karl Landsteiner découvre les groupes sanguins (système ABO) et les premières transfusions de sang humain sont réalisées. Pendant la première guerre mondiale, de nombreuses progrès sont réalisés particulièrement au niveau de la phase de recueil du sang chez le donneur.
• 1928 : le premier Centre de transfusion sanguine est fondé à l’Hopital Saint Antoine.
• 1936 : Norman Bethune créé le concept de collecte mobile.
• 1940 : Karl Landsteiner et Wiener découvre le facteur Rhésus afin d’administrer des produits de plus en plus sécurisés pour les patients.
• 1956 : afin d’améliorer la sécurité transfusionnelle, la détermination des groupes sanguins ABO et des Rhésus est réalisée sur les dons ainsi que le dépistage de la syphilis.
• 1983 : les premières détections des recherche d’agglutinines irrégulières (RAI) sont effectuées chez les patients receveurs.
• 1985 : Détection des anticorps anti VIH. De 1985 à 1990, 4400 personnes sont contaminés par le virus du sida, entrainant de fait de nombreuses lois et réglementations afin de garantir la sécurité des donneurs et des receveurs lors des dons et des transfusion.
• 2000 : création de l’Etablissement francais du sang. Depuis 2001, de nombreux dépistages sont effectués sur chaque don (Hépatite B, C, virus du SIDA…) dans le but de minimiser la transmission de virus et de sécuriser au maximum l’acte transfusionnel dans sa globalité
Plaies aiguës et chroniques : vers une cicatrisation dirigée | |
|---|---|
| Notre formation "Plaies aiguës et chroniques : vers une cicatrisation dirigée" en e-learning a été spécialement développée pour vous permettre de prendre en charge tous les types de plaies, aiguës ou chroniques, effectuer un choix logique de pansements et mettre en place une cicatrisation dirigée. En savoir plus | |
Formez-vous à distance grâce au 100% e-learning | |
|---|---|
| Vous travaillez en établissement de santé ou en structure sociale ou médico-sociale ? Découvrez notre sélection de formations disponibles en e-learning et spécialement conçues pour les infirmier(s). En savoir plus | |















Vous devez être connecté pour poster un commentaire.