Relève de l’hémostase primaire | |
Relève de l’hémostase secondaire | |
| Relève de la fibrinolyse |
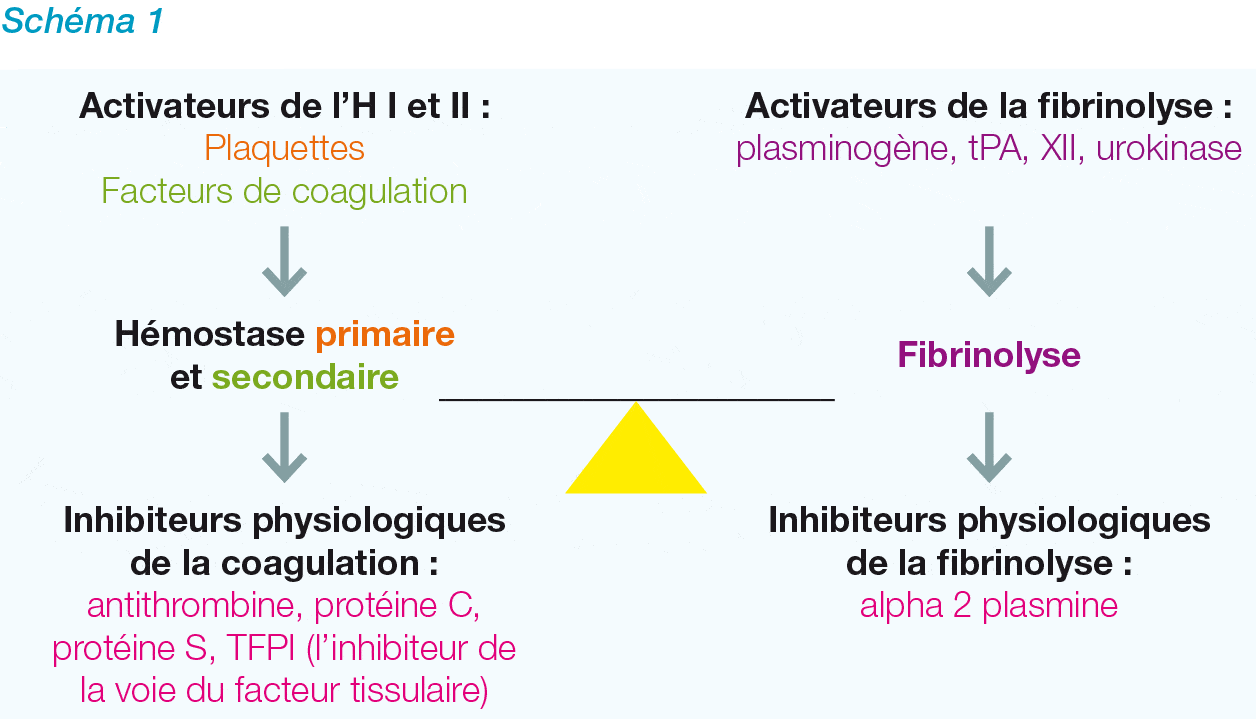
L’hémostase (H) vise un équilibre physiologique subtil entre un processus coagulant, susceptible d’entraîner un accident thrombotique, et un processus de fibrinolyse, à risque hémorragique. Ces processus sont régulés eux-mêmes par des inhibiteurs et des activateurs (schéma 1). Le déficit d’un de ces acteurs entraînera un risque hémorragique ou au contraire un risque de thrombose chez le patient.
Les principaux acteurs sont la paroi vasculaire, les plaquettes, les facteurs de la coagulation, ceux de la fibrinolyse et d’autres protéines plasmatiques. L’hémostase se compose de trois étapes essentielles, de la réparation du vaisseau endommagé à sa réimperméabilisation ultérieure :
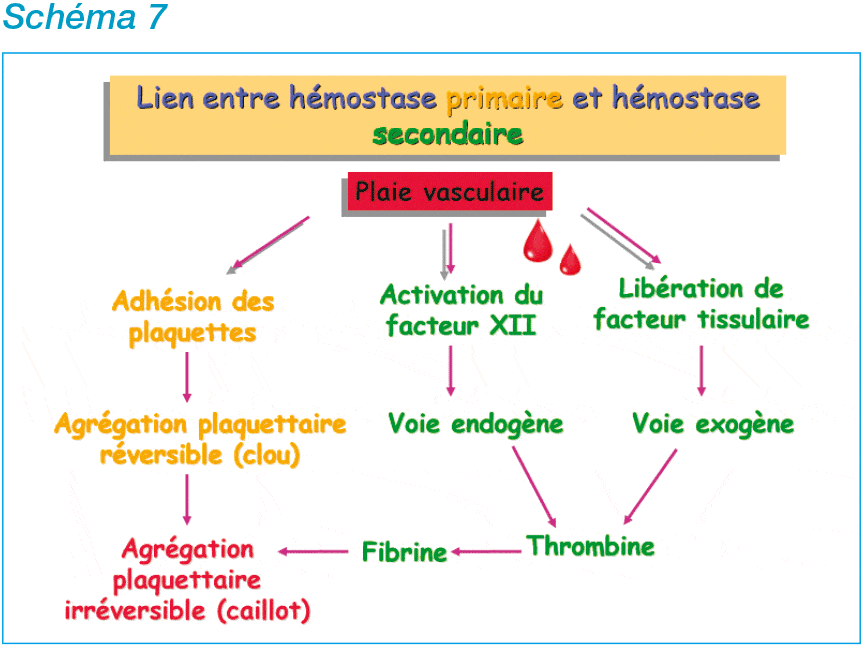
• l’hémostase primaire avec la formation du clou plaquettaire ;
• l’hémostase secondaire ou coagulation proprement dite aboutissant à la formation du caillot de fibrine insoluble ;
• la fibrinolyse qui concerne la dissolution du caillot. A l’inverse, la survenue d’une thrombose est une anomalie de l’hémostase.
>> LIRE AUSSI – L’hémostase : anomalies, examens biologiques et principaux traitements >>
Sommaire
TogglePhysiologie de l’hémostase

• La première étape de l’hémostase primaire est le spasme vasculaire. C’est une vasoconstriction locale qui entraîne une diminution du flot sanguin, minimise la perte de sang et favorise l’accumulation de plaquettes sanguines et de facteurs de la coagulation.
Les plaquettes s’agglutinent ensuite à la paroi du vaisseau sanguin pour former une fine membrane ou clou plaquettaire ou thrombus blanc et obturer la brèche vasculaire. C’est la deuxième étape de l’hémostase primaire.
• Puis, au cours de l’hémostase secondaire, les filaments de fibrine (facteur I) emprisonnent les globules rouges, les globules blancs et d’autres plaquettes afin de créer un maillage serré, beaucoup plus résistant. Ensuite, grâce à une cascade de réactions impliquant différents facteurs de coagulation, les filaments de fibrine se polymérisent et se cristallisent pour former le caillot sanguin.
• Enfin, lorsque le vaisseau sanguin est cicatrisé, des enzymes dissolvent le caillot. C’est la fibrinolyse. La circulation sanguine peut reprendre son cours normal.
La première phase de l’hémostase ou hémostase primaire
Le spasme vasculaire
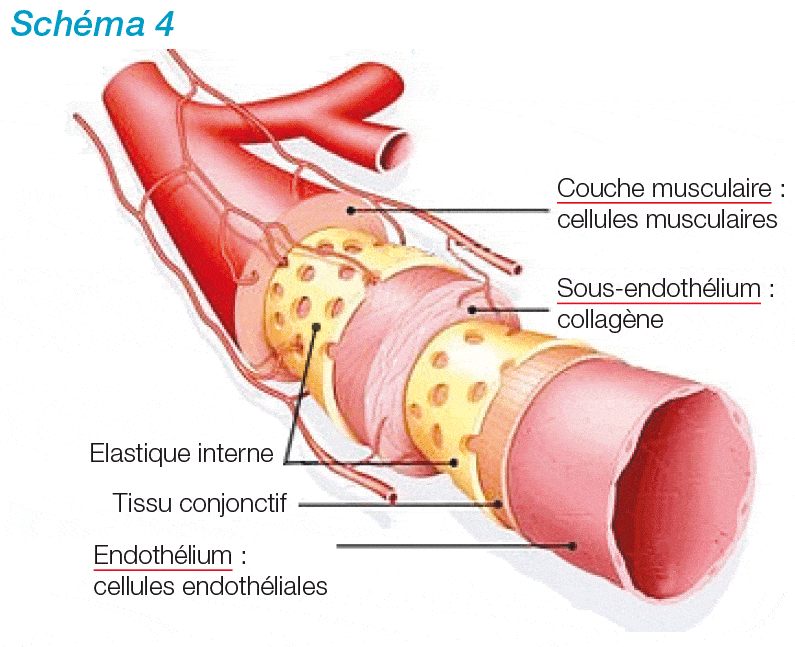
• La couche la plus interne du vaisseau est l’endothélium. C’est une couche monocellulaire, composée de cellules endothéliales. Ces cellules sont impliquées dans le maintien d’une certaine fl uidité du sang. Elles sécrètent des substances – la prostacycline (PGI2) et l’oxyde nitrique ou monoxyde d’azote (NO) – qui maintiennent la fl uidité du sang et préviennent l’agglutination des plaquettes sanguines. Au contraire, en cas de lésion vasculaire, elles secrètent et libèrent le facteur de Willebrand.
• La couche sous-endothéliale. C’est une couche qui contient du collagène, les plaquettes sanguines se colleront à ce collagène lors d’une brèche vasculaire.
• La couche musculaire. Elle participe aussi à l’hémostase. Cette couche de cellules musculaires lisses va, en se contractant, réduire le débit sanguin local favorisant l’accumulation de plaquettes sanguines et autres molécules impliquées dans la formation du caillot sanguin.
Le spasme vasculaire, première étape de l’hémostase primaire, est une contraction locale des muscles lisses du vaisseau sanguin à l’endroit où s’est produit le dommage vasculaire. Ce spasme intervient assez rapidement, en 15 à 60 secondes, et peut durer 20 à 30 minutes. C’est à la fois l’atteinte du muscle lisse lui-même, l’activité des nocicepteurs (récepteurs de la douleur) et la libération de calcium et de sérotonine (5-HT, 5-hydroxytryptamine) par l’endothélium vasculaire et les plaquettes qui entraînent ce spasme. En se contractant, le vaisseau sanguin diminue de diamètre ce qui réduit le flot sanguin et diminue les pertes sanguines à cet endroit et, dans le même temps, favorise l’accumulation de plaquettes sanguines et des facteurs de coagulation.
La formation du clou plaquettaire
Les plaquettes sanguines, aussi appelées thrombocytes, sont le premier maillon à participer à la formation du clou plaquettaire. Issues de la moelle osseuse, les plaquettes sont des fragments de cellules, de 2 à 4 μm de diamètre, plus petites que les globules rouges (7μm), au nombre de 150-450 milliards par litre de sang. Elles ont une durée de vie de 7 à 10 jours et sont détruites dans la rate.
Dépourvues de noyau, ces fragments de cellules sont de véritables soucoupes volantes multifonctions. En effet, elles sont constituées de :
• une double membrane lipidique avec de nombreux récepteurs leur permettant d’adhérer les unes aux autres ;
• des mitochondries et de glycogène qui fournissent de l’énergie ;
• des granules denses qui contiennent du calcium, de l’ADP (adénosine diphosphate) et de la sérotonine (5- HT) ;
• des granules alpha qui contiennent du fibrinogène, des facteurs de coagulation (V, VII, XI, XII, facteur de Willebrand…) et des facteurs de croissance ;
• des lysosomes qui contiennent des enzymes protéolytiques pour digérer certaines protéines ;
• des filaments d’actine et de myosine leur permettant de se contracter et de se déformer.

A NOTER : le facteur de Willebrand est synthétisé et stocké dans les granules des plaquettes (20 %) et dans les cellules endothéliales des vaisseaux (80 %). Il a deux rôles essentiels : favoriser l’adhésion des plaquettes au vaisseau lésé (cellules sous endothéliales) et transporter le facteur VIII. Vous comprenez maintenant l’importance du facteur de Willebrand dans l’hémostase. Un patient porteur d’une maladie de Willebrand nécessitera donc une prise en charge particulière avant toute intervention chirurgicale.
L’hémostase secondaire
Cette étape est indispensable car elle permet de renforcer le clou plaquettaire grâce à la production de fibrine pour aboutir à la formation d’un caillot insoluble. La cascade de coagulation est constituée de deux voies (endogène et exogène) qui mènent à la formation de fibrine.
C’est une étape complexe qui prend de trois à six minutes et implique une cascade d’activation de facteurs de coagulation et la polymérisation de filaments de fibrine. De plus, des globules blancs et des globules rouges s’emmêlent aux filaments de fibrine et aident à mieux sceller le dommage vasculaire.
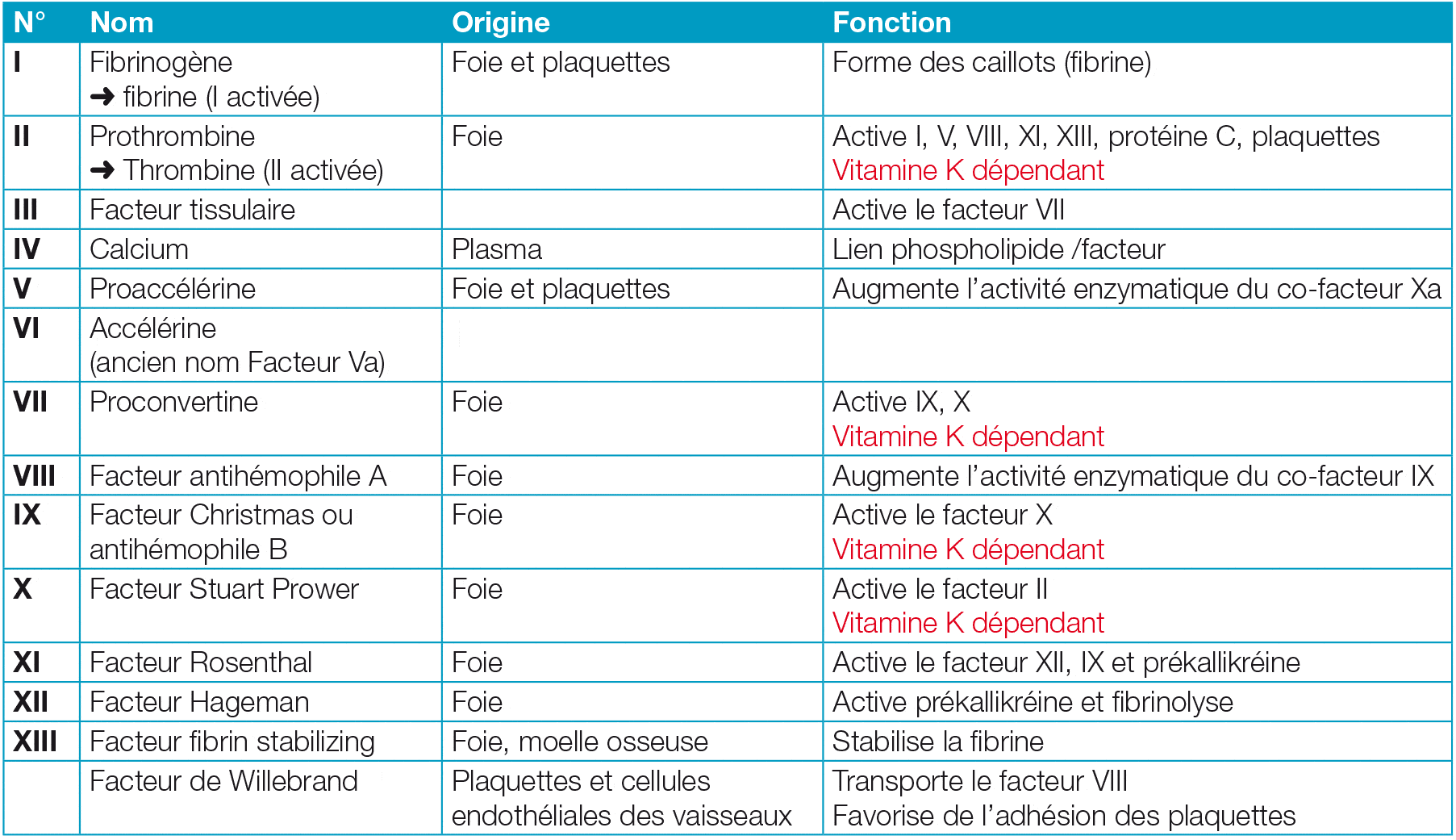
Le rôle des facteurs de coagulation.
Les facteurs de coagulation, comme leurs noms l’indiquent, sont des molécules impliquées dans la coagulation du sang. Ils sont normalement identifiés par des chiffres romains, avec un « a » minuscule pour indiquer la forme « activée ». La plupart de ces facteurs sont des molécules circulant dans le sang, à l’exception du facteur tissulaire (facteur III) qui sera libéré par les cellules endothéliales lors d’un dommage d’un vaisseau sanguin. La plupart de ces facteurs sont produits au niveau du foie, et pour certains, leur production est dépendante de la vitamine K.
Ceci peut expliquer les désordres hémorragiques chez les patients cirrhotiques ou atteints d’une insuffisance hépatocellulaire. De même, les déficits en vitamine K pourront influencer la synthèse des facteurs de coagulation – vitamine K dépendants – et donc la coagulation du sang.
Les facteurs de coagulation
A NOTER : le rôle de la vitamine K est important dans la synthèse de certains facteurs de coagulation (II, VII, IX et X). Un traitement par anti- vitamine K (AVK) inhibe donc la synthèse des facteurs vitamine K dépendant pour éviter le risque de récidive de thrombose.
La cascade d’activation des facteurs de coagulation
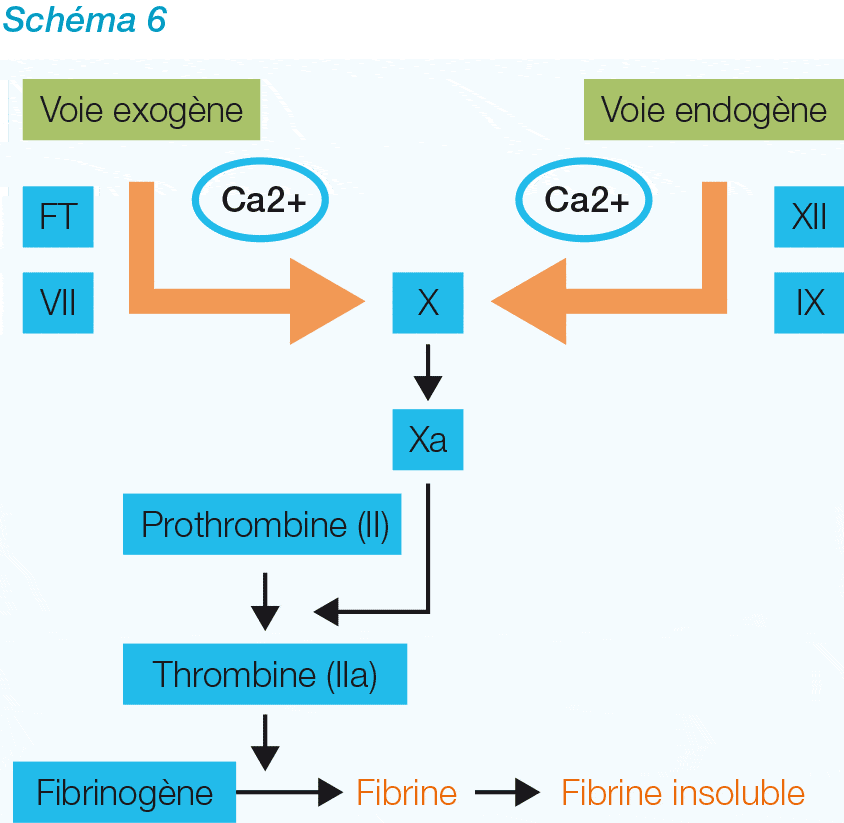
• La voie endogène sollicite les facteurs de coagulation qui sont dissous dans le sang. La voie endogène est la voie la moins importante. En cas de déficit (facteur XII ou PK ou KHPM), il n’y aura pas de syndrome hémorragique grave.
• La voie exogène est la voie la plus importante dans l’initiation de la coagulation et son rôle principal est de générer très rapidement une grande quantité de thrombine. Le facteur tissulaire (FT ou facteur III) provenant du tissu endommagé et le facteur VII activé vont activer le facteur X en facteur Xa.
• La voie commune : la cascade se poursuit. Grâce au facteur X activé, la prothrombine (facteur II) sera activée en thrombine qui polarisera le fibrinogène (facteur I) en filaments de fibrine insoluble et activera le facteur XIII qui à son tour stabilisera le caillot sanguin.
Les inhibiteurs de la coagulation
A NOTER : lors de déficits d’antithrombine, de protéine C, S, les substances anticoagulantes – une sorte d’héparine naturelle – sont moindres. Du fait de ce déséquilibre, le mécanisme de coagulation prend le pas et le risque de thrombose devient majeur. Ce qui expose les patients porteurs de déficit en protéine C, S à la maladie thromboembolique.
A NOTER : le calcium (facteur IV) intervient à plusieurs niveaux dans la coagulation. C’est la raison pour laquelle les tubes de prélèvements sanguins contiennent un chélateur de calcium pour le neutraliser. Donc sans calcium, il n’y a pas de coagulation ! Le sang reste fluide et les analyses peuvent s’effectuer.
La fibrinolyse
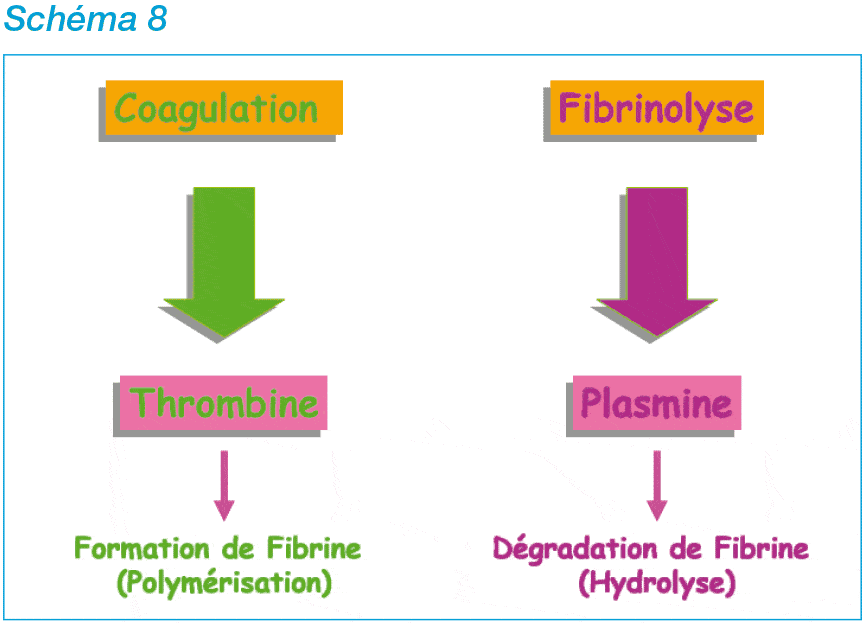
Ce processus de fibrinolyse permettra de limiter l’extension du caillot et de le lyser. Le système fibrinolytique consiste en une cascade de protéines : des activateurs et des inhibiteurs qui régulent la formation de la plasmine, substance capable de détruire la fibrine. Des troubles à ce niveau engendrent une hypercoagulabilité, responsable d’un risque de thrombose.
Les activateurs de la fibrinolyse
L’acteur principal est le plasminogène. Grâce à l’activateur tissulaire du plasminogène (t-PA) et l’urokinase, le plasminogène va être activé en plasmine et permettre la dissolution du caillot de fibrine.
Les inhibiteurs de la fibrinolyse
Les deux principaux inhibiteurs des activateurs du plasminogène sont le PAI-1 et 2.
Ainsi, après quelques jours, lorsque le dommage vasculaire sera réparé, il y aura fibrinolyse ou dissolution de la fibrine. C’est la dégradation du caillot.
Lorsque l’endothélium est reconstitué, il sécrète l’activateur tissulaire du plasminogène (t-PA) qui activera le plasminogène déjà présent dans le caillot. Le plasminogène se transformera alors en plasmine, enzyme qui dégradera la fibrine du caillot sanguin. Le facteur XII pourrait également stimuler l’activation du plasminogène et participer à la fibrinolyse. Le vaisseau sanguin est maintenant complètement rétabli et la circulation sanguine est redevenue normale.
A NOTER : la destruction du caillot va générer des produits de dégradation de la fibrine appelés D-Dimères dont la mesure est très utile pour exclure une maladie thromboembolique veineuse. Son interprétation doit toutefois est prudente. Le taux peut être élevé dans tous les états d’activation de la coagulation : CIVD, cancer, infections, chirurgie récente…
Conclusion
L’hémostase est souvent comparée à une balance. En effet, la fluidité du sang est maintenue grâce à un judicieux équilibre entre activateurs (plaquettes, facteurs de la coagulation) et inhibiteurs physiologiques de l’hémostase (antithrombine, protéine C, protéine S). Toute perturbation de cet équilibre engendre un processus pathologique qui peut menacer la vie du patient. Dans le prochain numéro seront abordés les anomalies de l’hémostase, les examens sanguins et les différents traitements anticoagulants ainsi que leur surveillance.
Laurence Piquard
IADE Infirmière anesthésiste

Il est à présent en accès libre. ActuSoins vit grâce à ses abonnés et garantit une information indépendante et objective. Pour contribuer à soutenir ActuSoins, tout en recevant un magazine complet (plus de 70 pages d’informations professionnelles, de reportages et d’enquêtes exclusives) tous les trimestres, nous vous invitons donc à vous abonner.
Plaies aiguës et chroniques : vers une cicatrisation dirigée | |
|---|---|
| Notre formation "Plaies aiguës et chroniques : vers une cicatrisation dirigée" en e-learning a été spécialement développée pour vous permettre de prendre en charge tous les types de plaies, aiguës ou chroniques, effectuer un choix logique de pansements et mettre en place une cicatrisation dirigée. En savoir plus | |
Formez-vous à distance grâce au 100% e-learning | |
|---|---|
| Vous travaillez en établissement de santé ou en structure sociale ou médico-sociale ? Découvrez notre sélection de formations disponibles en e-learning et spécialement conçues pour les infirmier(s). En savoir plus | |












Vous devez être connecté pour poster un commentaire.