
La peau est l’interface qui sépare le milieu intérieur de l’environnement qui nous entoure. Son rôle est fondamental car il permet d’éviter le contact du milieu intérieur (stérile) avec l’environnement qui nous entoure (non stérile).
Parfois, des germes se développent au sein des plaies. Une interaction entre l’hôte, le germe et l’environnement va alors se créer, susceptible de modifier l’évolution de la cicatrisation.
Contamination, prolifération et infection
Toutes les plaies peuvent être contaminées par des micro-organismes mais le germe ne se multipliera pas, ni ne persistera, si les conditions nutritives et environnementales ne lui sont pas favorables ou s’il ne parvient pas à échapper aux défenses de l’hôte. A ce stade – défini comme celui de la contamination de la plaie -, sa présence n’est donc que temporaire et elle ne perturbera pas la cicatrisation de la plaie.
Celui de la prolifération bactérienne est atteint lorsque les germes prolifèrent et se divisent, mais ne provoquent pas de lésions tissulaires et n’altèrent pas le fonctionnement cellulaire physiologique de l’hôte.
Celui de l’infection est caractérisé lorsque la prolifération des germes dans les tissus de l’hôte provoque des lésions cellulaires et des réactions immunitaires symptomatiques de l’hôte, ce qui entraîne une interruption de la cicatrisation de la plaie.
>> LIRE AUSSI – Optimiser la guérison des plaies chroniques par une gestion efficace de l’exsudat <<
Le processus de la prolifération bactérienne et l’infection
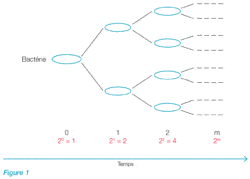
Théoriquement, une bactérie, placée dans un milieu convenable, peut se multiplier indéfiniment, par fission binaire. La croissance se fait selon une progression géométrique : 1, 2, 4, 8, etc. ou 20, 21, 22, 23,… 2n (où n = nombre de générations). Il s’agit d’une croissance exponentielle.
Ce phénomène relève de la notion de cinétique de prolifération et le développement exponentiel des germes, mis dans un milieu favorable, se fait rapidement au détriment de l’hôte. Par conséquence, si ce développement est plus rapide que la réaction immunitaire, une colonisation de la plaie au profit de l’infection se produit.
Il s’en suit des réactions inflammatoires au sein de la plaie. Ces dernières se traduisent, entre autres, par la production massive d’exsudat.
Il existe donc un lien entre l’infection et l’exsudat. En effet pour se développer, les germes ont besoin d’évoluer dans un environnement chaud et humide.
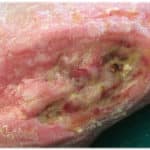
Reconnaître une plaie infectée
• érythème
• chaleur
• odeur nauséabonde
• augmentation de la température locale
• dégradation de la plaie
• retard de cicatrisation/élargissement du lit de plaie
• augmentation du volume de production d’exsudat.
La gestion des plaies infectées et les pansements absorbants
Cette gestion est efficace si elle est portée par un travail d’équipe, par une collaboration étroite entre les équipes soignantes, les dispositifs médicaux et le patient.
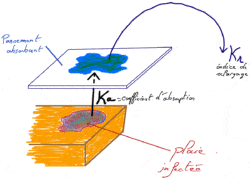
L’utilisation de pansements à forte capacité d’absorption – Ka élevé – (cf. ActuSoins n° 19, p. 16) permet ainsi une meilleure efficacité. Cependant une autre variable va optimiser considérablement cette recherche d’efficacité : l’indice de relargage (Kr).
Un pansement bactériostatique a la capacité au travers de son faible indice de relargage – Kr faible – de garder les germes au sein de sa matrice (figure 2).
Ainsi, en utilisant des pansement à Ka élevé (forte absorption) et à faible Kr (faible indice de relargage), les germes seront maintenus au sein de la matrice du pansement et ne seront donc plus sur le lit de la plaie ni sur les berges.
Autre phénomène à prendre en compte : les germes ont une cinétique de multiplication temporelle, c’est-à-dire que la charge bactérienne augmente au fil du temps si les germes restent présents sur l’hôte.
Par conséquent, outre l’utilisation de pansement bactériostatique, une augmentation de la fréquence de changement du pansement par 24 h permet de casser cette cinétique multiplicative des bactéries, provoquant une diminution par unité de temps de la charge bactérienne.
Changer le pansement deux ou trois fois par jour, dans le cadre d’une plaie infectée, permet ainsi de casser la cinétique bactérienne et d’optimiser la cicatrisation.
Tableau sur la classification des pansements
Classement des pansements en fonction de la TENE
Philippe Viseux de Potter,
PDG D’I-CICA Institut de la Cicatrisation,
Directeur d’Atousoins formation continue.
Cet article est initialement paru dans le n°26 (octobre 2017) d’ ActuSoins Magazine.
Pour recevoir ActuSoins chez vous, c’est ICI
Abonnez-vous au magazine Actusoins
Références
1. Kupper TS, Fuhlbrigge RC. Immune surveillance in the skin : mechanisms and clinical consequences. Nat Rev Immunol 2004 ; 4 : 211-22.
2. Ayton M. Wound care : wounds that won’t heal. Nurs Times 1985 ; 81(46) : suppl 6- 19.
3. Heinzelmann M, Scott M, Lam T. Factors predisposing to bacterial invasion and infection. Am J Surg 2002 ; 183(2) : 179-90.
4. Davis E. Education, microbiology and chronic wounds. J Wound Care 1998 ; 7(6) : 272-74.
5. Pozzilli P, Leslie RD. Infections and diabetes : mechanisms and prospects for prevention. Diabet Med 1994 ; 11(10): 935-41.
6. Kingsley A. A proactive approach to wound infection. Nurs Stand 2001 ; 15(30) : 50- 58.
7. Hunt TK. Surgical wound infections : an overview. Am J Med 1981 ; 70(3) : 712-18.
8. Fumal I, Braham C, Paquet P, et al. The beneficial toxicity of antimicrobials in leg ulcer healing impaired by a polymicrobial flora : a proof-of-concept study. Dermatology 2002 ; 204 (suppl 1) : 70-74.
9. Greif R, Akca O, Horn EP, Kurz A, Sessler DI. Supplemental perioperative oxygen to reduce the incidence of surgical wound infection. Outcomes Research Group. N Eng J Med 2000 ; 342(3): 161-67.
10. Jørgensen B, Price P, Andersen KE, et al. The silver-releasing foam dressing, Contreet Foam, promotes faster healing of critically colonised venous leg ulcers : a randomised, controlled trial. Int J Wounds 2005 ; 2(1) : 64-73.
11. Melling AC, Ali B, Scott EM, Leaper DJ. Effects of preoperative warming on the incidence of wound surgery after clean surgery : a randomised controlled trial. Lancet 2001 ; 358(9285): 876-80.
12. Casadevall A, Pirofski LA. Host-pathogen interactions : redefining the basic concepts of virulence and pathogenicity. Infect Immun 1999 ; 67(8) : 3703-13. Casadevall A, Pirofski LA. Host-pathogen interactions : basic concepts of microbial commensalism, colonization, infection, and disease. Infect Immun 2000 ; 68(12) : 6511-18
13. Wilson JW, Schurr MJ, LeBlanc CL, et al. Mechanisms of bacterial pathogenicity. Concepts of virulence and pathogenicity. Infect Immun 1999 ; 67(8): 3703-13. Postgrad Med J 2002 ; 78 : 216-24.
14. Van Delden C, Iglewski BH. Cell-to-cell signalling and Pseudomonas aeruginosa infections. Emerg Infect Dis 1998 ; 4(4) : 551-60.
15. Norme EN13726 chapitre 3.
16. Articles pour pansements (Titre Ier, chapitre 3, section 1 de la liste des Produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale).
17. Décret n° 2004-1419 du 23 décembre 2004 relatif à la prise en charge des produits et prestations mentionnés à l’article L. 165-1 du code de la sécurité sociale.
18. Arrêté du 12 juillet 2005 (au journal officiel du 28 juillet 2005).
19. Auto-saisine de la CEPP en date du 7 février 2007 concernant notamment les descriptions génériques articles pour pansements.
20. La Commission d’Evaluation des Produits et Prestations recommande de modifier les conditions d’inscription des articles pour pansements, conformément au projet de nomenclature.
21. Commission nationale d’évaluation des dispositifs médicaux et technologies de santé (CNEDiMTS) de la Haute Autorité de Santé (HAS). A la suite de ce rapport, la nomenclature des pansements remboursables a été modifiée (arrêté du 16 juillet 2010, paru au J.O. du 7 août 2010).






Vous devez être connecté pour poster un commentaire.