Focus sur l’Hygiène des Plaies : une stratégie anti-biofilm pro-active recommandée par les Experts.
L’Hygiène des Plaies est une stratégie antibiofilm issue de recommandations internationales, et récemment adaptée aux pratiques et au système de soins en France, par un groupe d’experts français1, 2. Le biofilm est en effet un ennemi invisible présent dans 78,2% des plaies chroniques3.
Le biofilm est une organisation bactérienne composée d’une flore polymicrobienne synthétisant une matrice tridimensionnelle protectrice, lui permettant d’échapper à l’action des antibactériens et des réponses immunitaires de son hôte2,4.
De diagnostic difficile car invisible à l’œil nu, un biofilm doit être suspecté dans toute plaie difficile à cicatriser malgré des soins standards bien conduits et une prise en charge globale adaptée2.
Le biofilm est en effet responsable de retards de cicatrisation, exposant la plaie à des risques d’infection récurrente, une stratégie efficace est donc nécessaire pour amener la plaie à progresser vers la guérison.
L’Hygiène des Plaies repose ainsi essentiellement sur la réduction de la charge bactérienne et la déstabilisation de la matrice protectrice. Il s’agit d’un protocole de soins locaux suivant 4 étapes à pratiquer à chaque changement de pansement dans le cadre d’une stratégie pro-active, et quotidiennement en présence de signes cliniques d’infection dans le cadre d’une stratégie curative2.
Une étape préliminaire est nécessaire afin de rechercher les causes de non cicatrisation, et mettre en place une prise en charge adaptée. La douleur doit faire l’objet d’une évaluation, et le cas échéant d’un traitement approprié car péjorative pour la qualité de vie du patient, elle peut également être un frein à la qualité des soins.
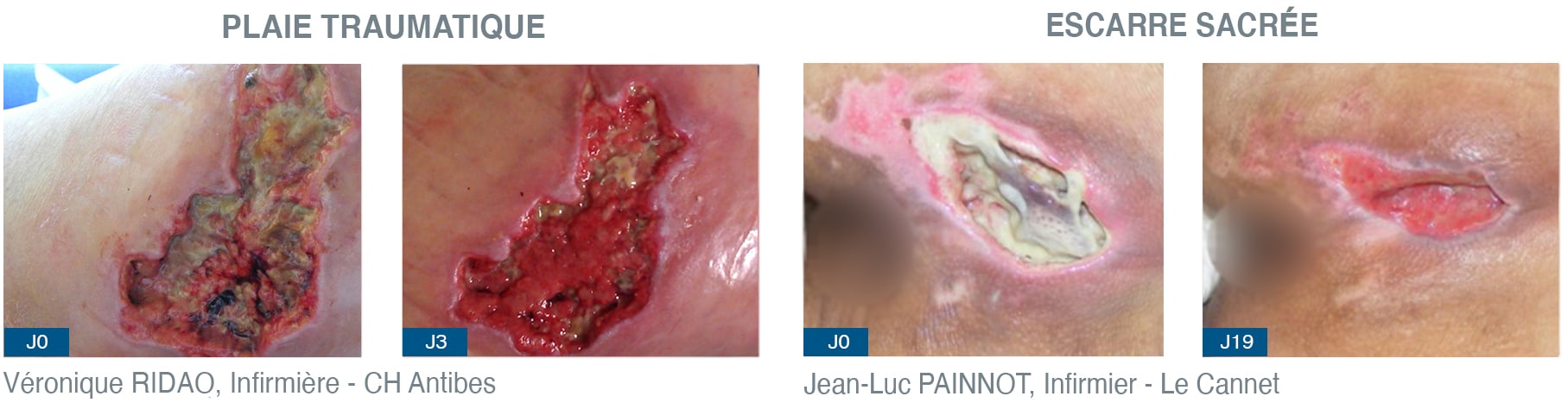
La 1ère étape est celle du nettoyage et consiste à assainir la peau périlésionnelle et le lit de la plaie en réduisant les contaminants de surface, et en éliminant les débris tissulaires non adhérents et les résidus de pansement. Le nettoyage se fait préférentiellement à l’eau du robinet dont la sureté d’utilisation a été démontrée, et au savon liquide neutre, il peut se faire également au sérum physiologique2 ; toutefois il faut rappeler que le nettoyage doit être réalisé avant et après la détersion et qu’il doit intéresser l’entièreté du membre ou de la zone concernés. L’effet mécanique du lavage présente déjà d’importants bénéfices dans la déstabilisation du biofilm2.
La 2nde étape est celle de la détersion qui joue un rôle essentiel dans l’élimination physique du biofilm, permettant de perturber sa matrice protectrice en vue de la rendre perméable, d’exposer les micro-organismes et les rendre vulnérables. Si la détersion du lit de la plaie concerne les tissus nécrotiques et fibrineux, elle s’applique également dans ce cas au tissu bourgeonnant.
La détersion mécanique par l’infirmière se fait à l’aide de différents instruments, tels que la curette, les pinces, les ciseaux et les compresses sèches tissées particulièrement adaptées à l’essuyage du tissu de granulation.
La détersion peut en revanche présenter des contre-indications, telles que les nécroses ischémiques non revascularisées, les plaies tumorales ou encore les angiodermites nécrotiques, elle doit être prudente chez les patients sous anti-coagulants et chez les patients neuropathiques2. Il est recommandé de recueillir un avis d’expert en cas de doute.
La 3ème étape concerne les berges de la plaie dont la prise en charge ne doit pas être négligée. En effet l’activité cellulaire aux bords de la plaie est majeure pour sa fermeture. Les myofibroblastes dermiques concourent à la progression centripète du tissu de granulation à partir des bords de la plaie vers le centre et du fond vers le sommet, l’épithélialisation progresse alors depuis les berges sur ce nouveau tissu bourgeonnant. Or le biofilm entraine une senescence des fibroblastes entravant l’apparition du nouveau tissu sain5, de même qu’il entraine une accumulation de cellules épithéliales au bord de la plaie à l’origine d’un épaissement des berges interférant alors dans le processus d’épidermisation6. Ainsi le nettoyage et la détersion des berges de la plaie sont primordiaux. De même qu’il faut les sonder afin de dépister tout éventuel décollement favorisant la prolifération bactérienne et pouvant faire le lit d’un biofilm. D’autres freins à la progression de l’épithélium doivent être traités, tels que les squames, les hyperkératoses, les phénomènes de macération ou encore l’hyperbourgeonnement.
La 4ème étape repose sur le choix du pansement qui doit être guidé par les caractéristiques de la plaie et les performances du pansement.
Les pansements modernes permettant la cicatrisation en milieu humide qualifiés de neutres, peuvent réduire la charge bactérienne en favorisant l’élimination des tissus fibrino-nécrotiques constituant un environnement propice au biofilm, mais également par des propriétés d’absorption/séquestration, de rétention, et d’adsorption qui leur confèrent des propriétés bactériostatiques. Ils peuvent être utilisés en stratégie pro-active et curative.2,7
Les pansements en fibres de CMC (carboxyméthylcellulose) issues de la Technologie Hydrofiber® ont été développés par les Laboratoires Convatec et sont des pansements à haut pouvoir d’absorption indiqués dans la prise en charge des plaies aiguës et chroniques exsudatives sans distinction de phase8, qui ont démontré leurs bénéfices dans la détersion.
Les fibres de CMC Hydrofiber® réduisent significativement la masse du biofilm9, et ont démontré une capacité significative à adsorber des bactéries antibiorésistantes de biofilms modèles matures10.
Ces données récentes sont en corrélation avec celles de Bowler et al (1999) : les auteurs ont mis en évidence de façon significative, que les fibres de CMC Hydrofiber® ont des capacités à absorber/séquestrer les bactéries associées à des capacités de rétention bactérienne11.
Dans le cadre d’une stratégie pro-active, ces différents mécanismes peuvent constituer une combinaison optimale susceptible de fournir une meilleure efficacité dans la réduction de la charge bactérienne et la lutte contre la formation du biofilm.
Conclusion
Les plaies difficiles à cicatriser ont des répercussions majeures sur la qualité de vie des patients et constituent un fardeau humain et financier préjudiciable pour les systèmes de santé.
Si les causes de non cicatrisation doivent être recherchées, localement le biofilm est un facteur de retard de cicatrisation et d’infections récurrentes impliqué dans près de 80% des plaies chroniques.
Dans ce contexte, une Hygiène des Plaies pro-active rigoureuse pratiquée en routine à chaque changement de pansement, doit permettre aux plaies difficiles à cicatriser de progresser vers la cicatrisation. Les pansements ayant démontré des propriétés de séquestration, de rétention et d’adsorption bactériennes peuvent contribuer à la lutte contre la formation du biofilm et la gestion du risque d’infection.
Nathalie GIGLIO DUVAL, Laboratoires Convatec
Spécialiste Education Médicale Cicatrisation
Retrouvez la e-publication de l’Adaptation française par un groupe d’experts français des recommandations internationales sur l’Hygiène des Plaies difficiles à cicatriser : https://soin-868-s1.elsevierdigitaledition.com/
1 Murphy C et al. Defying hard-to-heal wounds with an early antibiofilm intervention strategy : “Wound hygiene”. J Wound Care 2019 ; 28:818-22.
2 Faucher N et al. Hygiène des Plaies difficiles à cicatriser dans la pratique clinique en France. Adaptation par un groupe d’experts français d’un consensus international sur l’intérêt d’une stratégie anti-biofilm. SOiNS – Supplément 1 au N°868 – septembre 2022
3 Malone M et al. The prevalence of biofilms in chronic wounds : a systematic review and meta-analysis of published data. J Wound Care 2017 ; 26(1):20-25.
4 Phillips PL, Wolcott RD, Fletcher J, Schultz GS. Biofilms Made Easy. Wounds International 2010 ; 1(3) : Disponible sur : http://www.woundsinternational.com
5 Madden L, Low SH, Phillips ARJ, Kline KA, Becker DL. The effects of Staphylococcus aureus biofilm conditioned media on 3T3 fibroblasts. FEMS Microbes. 2021. doi : 10.1093/femsmc/xtab010
6 Gurjala et al. Development of a novel, highly quantitative in vivo model for the study of biofilm-impaired cutaneous wound healing. Wound Rep Reg (2011) 19 400–410.
7 World Union of Wound Healing Societies (2020) The role of non-medicated dressings for the management of wound infection. London: Wounds International. Available at : www.woundsinternational.com
8 Arrêté du 19 septembre 2013 relatif à la modification de la dénomination du paragraphe 5 « Pansements en fibres de carboxyméthylcellulose » et à l’inscription du pansement en fibres de polyacrylate URGOCLEAN des laboratoires URGO France au chapitre 3 du titre Ier de la liste des produits et prestations remboursables prévue à l’article L. 165-1 du code de la sécurité sociale
9 Parsons D et al. Enhanced Performance and Mode of Action of a Novel Antibiofilm Hydrofiber® Wound Dressing. BioMed Research International. 2016 ; 2016 : 7616471.
10 Meredith K et al. Ability of Hydrofiber and Hydrophobic Wound Dressings to Bind Bacteria from a Surface Using Planktonic and Mature Biofilm in Vitro Models. Poster PP023 EWMA 2019 à Gothenburg (Suède).
11 Bowler PG et al. Infection control properties of some wound dressing. J Wound Care. 1999;8(10) : 499-502





Vous devez être connecté pour poster un commentaire.