La commercialisation d’un médicament dérivé du cannabis attendue en 2015
Un médicament dérivé du cannabis, le Sativex, destiné à soulager certains patients atteints de sclérose en plaques devrait obtenir son feu vert à la commercialisation en France "d'ici la fin de l'année", selon l'agence du médicament ANSM, mais il ne sera disponible qu""en 2015", selon le laboratoire.
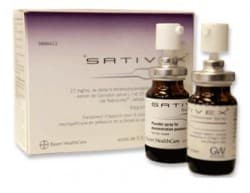 Le laboratoire Almirall qui distribuera en France ce spray buccal, déjà disponible dans de nombreux pays, espère pouvoir le commercialiser "au mieux en 2015", a indiqué lundi à l'AFP son pdg Christophe Vandeputte.
Le laboratoire Almirall qui distribuera en France ce spray buccal, déjà disponible dans de nombreux pays, espère pouvoir le commercialiser "au mieux en 2015", a indiqué lundi à l'AFP son pdg Christophe Vandeputte.
Pour sa part, l'agence du médicament ANSM "a reçu au mois de juillet la demande d'autorisation de mise sur le marché (AMM)" du laboratoire pour ce médicament, destiné au traitement des douleurs ou spasticité, et résistantes aux autres traitements, dont souffrent des patients atteints de SEP.
"L'AMM sera officiellement notifiée en France d'ici la fin de l'année", ajoute-t-on à l'agence du médicament.
Le laboratoire britannique GW Pharmaceuticals a confié la future commercialisation en France de son produit Sativex à son partenaire européen, le laboratoire Almirall.
Selon GW Pharmaceuticals, ce médicament est déjà "approuvé dans 22 pays, dont 17 pays européens".
Sativex est déjà enregistré dans d'autres pays d'Europe: Autriche, Allemagne, Belgique, Danemark, Espagne, Finlande, Irlande, Islande, Italie, Luxembourg, Norvège, Pays-Bas, Pologne, Portugal, République Tchèque,
Slovaquie et Suède, via une procédure européenne (dite "procédure décentralisée et de reconnaissance mutuelle") dont le Royaume Uni est le pays référent (RMS), explique l'ANSM.
Le laboratoire, qui a franchi la formalité européenne, doit à présent travailler avec l'agence française du médicament pour répondre à ses exigences spécifiques. Et, une fois l'AMM obtenue, il lui faudra aussi passer par le processus de fixation du prix et du remboursement, rappelle le pdg d'Almirall.
En France, depuis plusieurs années, un dérivé de cannabinoïde obtenu par synthèse, le Marinol (dronabinol), peut être prescrit pour des douleurs chroniques dans le cadre d'une autorisation temporaire d'utilisation (ATU), une procédure spéciale réservée à des pathologies pour lesquelles il n'existe pas de traitement approprié. Seule une centaine de patients en aurait bénéficié.
Rédaction ActuSoins, avec AFP












Celui qui existe ne se délivre que sur ATU nominative, c’est-à-dire pratiquement pas. A côté des douleurs neuropathiques, ses indications dans de nombreux pays sont aussi la reprise de l’appétit en phase très avancée ou terminale de maladies (Sida, K,..) , son action antinauséeuse lors des chimio anti-K, et antispastique dans certaines neuropathies (SEP, S. G de la Tourette).
Il en existe déjà sous un autre nom délivré sous dérogation
testé il y a déjà quelques années sur les personnes atteintes du sida : stimulerait l’appétit !
et les autres causes de douleurs neurogènes ?
je suis pas pour je préfère cent fois une bonne dose de morphine
si ça soulage vraiment les patients … alors hip hip hip … houra !!
enfin !!! on va pouvoir enfin etre soulage